2023年11月24日,上海理工大学骨科生物医学和器械创新研究院肖建如教授团队联合哈佛大学医学院魏文毅教授团队在国际著名医学期刊Cell Metabolism(IF:31.373)发表研究论文:“PRMT1 orchestrates with SAMTOR to govern mTORC1 methionine sensing via Arg-methylation of NPRL2”(PRMT1通过NPRL2的精氨酸甲基化与SAMTOR协同调控mTORC1甲硫氨酸的监测),与哈佛大学医学院联合培养的博士后姜丛为论文第一作者,肖建如教授和魏文毅教授为论文共同通讯作者。
肿瘤细胞通过感知外界营养(葡萄糖、氨基酸以及脂类)变化重塑细胞内的合成以及分解代谢, 从而适应肿瘤微环境中的营养变化并满足自身对于能量以及生物大分子的需求,肿瘤营养感应紊乱与肿瘤的发生和转移密切相关。与此同时,代谢途径的改变也赋予癌细胞对于某种代谢途径的依赖性,对这些代谢通路的干预为肿瘤的治疗提供了新的方法和策略,是肿瘤生物学研究的前沿领域及重要方向。肖建如教授团队联合魏文毅教授团队以“营养感应机制与其在肿瘤发展中的功能研究”为主要方向,围绕营养感知关键通路mTORC1, 阐明了细胞感受胞外氨基酸(甲硫氨酸/亮氨酸)的分子机制(Cell Metabolism, 2023; Molecular Cell, 2023),并且明确了其在肿瘤发展中的作用,为靶向营养感应的肿瘤药物研发提供了新靶点。
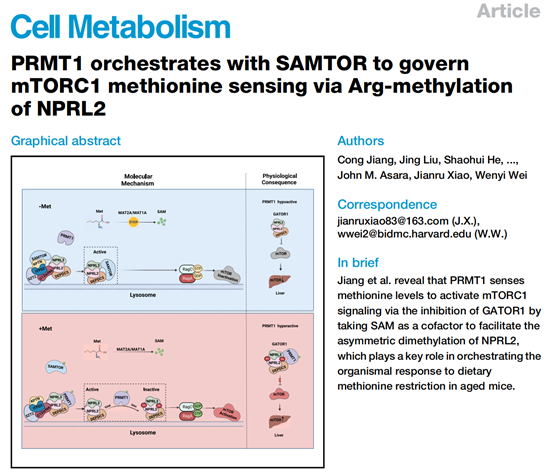
该研究报道PRMT1(蛋白精氨酸甲基转移酶1)通过直接感知细胞内S-腺苷蛋氨酸(SAM)水平对甲硫氨酸介导的mTORC1激活至关重要。在甲硫氨酸充足的条件下,升高的细胞质SAM使mTOR复合物中MTORC1上游的S-腺苷甲硫氨酸传感器(SAMTOR)与GATOR1复合物分离,而GATOR1复合物与蛋白质精氨酸甲基转移酶1(PRMT1)相互作用使NPRL2基因甲基化,从而抑制GATOR1的G蛋白G活性,导致mTORC1活化。更重要的是,PRMT1 -NPRL2-mTORC1轴在调节老年小鼠对甲硫氨酸限制饮食诱导的胰岛素抵抗以及肿瘤的发生发挥关键作用,证明PRMT1可以作为mTORC1信号的生理SAM传感器。在该研究基础上,肖建如教授团队将继续探索mTORC1通路营养感应与骨肿瘤发生以及骨相关转移癌的功能研究,并根据研究靶点开展转化及临床实验研究,助力癌症药物的研发。
肖建如教授简介:医学博士、教授、博士生导师、主任医师,现任上海理工大学骨科生物医学和器械创新研究院荣誉院长,海军军医大学第二附属医院(上海长征医院)骨科医院院长、全军骨科研究所所长、上海市重中之重脊柱疾病临床医学中心主任,上海市骨科临床医学研究中心主任,荣获国务院政府特殊津贴,上海市优秀学科带头人、上海市领军人才。


